1) Le proteine assumono spontaneamente una struttura nativa costituita dall'ordinato ripiegamento dei tratti ad alfa elica e a foglietto beta. La struttura nativa dipende soprattutto dagli angoli rotazionali fi e psi del legame peptidico. La struttura nativa e' determinata dalla sequenza aminoacidica ed e' necessaria ai fini della funzione biologica. Il processo cinetico nel quale la proteina acquisisce la sua struttura nativa si chiama folding, e la stessa struttura nativa costituisce il "folding" della proteina. Le principali forze attrattive che favoriscono la struttura nativa sono:
a) i legami idrogeno tra i gruppi CO ed NH del legame peptidico che stabilizzano le strutture secondarie periodiche (alfa elica, foglietto beta);
b) il sequestro dei residui aminoacidici non polari prevalentemente all'interno della struttura nativa (hydrophobic core), che li protegge dal contatto con l'acqua (nei tratti membranari delle proteine di membrana avviene l'opposto e i residui aminoacidici non polari sono esterni ed esposti all'interazione con i lipidi);
c) le interazioni specifiche tra residui aminoacidici distanti (ponti disolfuro; ponti salini; legami idrogeno; etc.).
2) Se esposte a solventi organici, ambienti fortemente basici o fortemente acidi, temperatura elevata o soluzioni di soluti capaci di perturbare la trama dei legami idrogeno (urea o guanidina). le proteine possono perdere la struttura nativa (processo di denaturazione, in inglese unfolding) e la funzione biologica.
3) Se l'unfolding avviene in condizioni controllate e su una soluzione diluita della proteina, il processo e' reversibile: la rimozione dell'agente denaturante si associa al refolding e la proteina ritrova struttura nativa e funzione biologica. Questo dimostra che nelle opportune condizioni sperimentali la struttura nativa e' un minimo termodinamico (ipotesi di Anfinsen). E' possibile che questa regola abbia eccezioni: la proteina inizia ad assumere la sua configurazione nativa prima che la biosintesi sia completata, e di conseguenza potrebbe trovare un minimo energetico (struttura) diverso da quello che assumerebbe in un esperimento di denaturazione-rinaturazione, che viene condotto sulla struttura definitiva della macromolecola.
4) La cinetica del processo di rinaturazione e' rapida; dapprima si riformano almeno parzialmente i tratti di struttura secondaria ordinata (che non erano necessariamente tutti perduti nel processo di denaturazione), poi si osserva il collasso della struttura complessiva, con la formazione del cosiddetto molten globule, che contiene il nucleo idrofobico della struttura nativa, e per finire il molten globule si riarrangia e si completano i segmenti di struttura secondaria per raggiungere la conformazione nativa. La proteina non esplora quindi casualmente lo spazio dei suoi possibili isomeri conformazionali, ma procede lungo un percorso facilitato, di minima energia (paradosso di Levinthal: le possibili varianti strutturali, dovute agli angoli rotazionali fi e psi sono troppe perché la proteina possa esplorarle tutte casualmente).
5) Se il processo di denaturazione avviene in condizioni in cui la proteina e' concentrata puo' accadere che le parti idrofobiche esposte al solvente si aggreghino tra loro e la proteina forma una massa che precipita ed esce dalla fase di soluzione; in questi casi la denaturazione e' irreversibile.
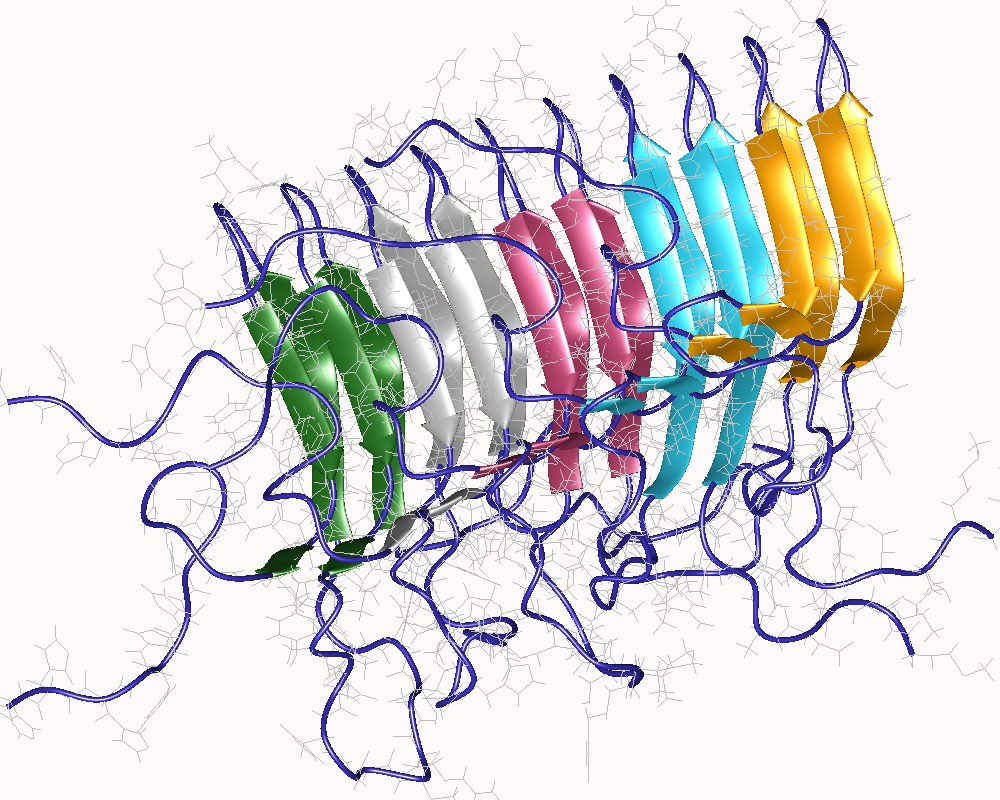
6) Tutte o quasi tutte le proteine, se poste in condizioni opportune di solvente e temperatura possono formare strutture non native prevalentemente a foglietto beta e capaci di aggregare in forma di fibre allungate formando un materiale precipitato che ha proprieta' tintoriali (cioe' di assorbimento dei coloranti per i preparati istologici) simili a quelle dell'amido ed e' percio' chiamato amiloide. L'amiloide e' uno stato denaturato, aggregato ed insolubile che uccide la cellula che lo contiene e rimane sotto forma di deposito nello spazio extracellulare. E' caratteristico soprattutto delle malattie neurodegenerative: Alzheimer, Parkinson, Creutzfeld-Jacob, insonnia familiare fatale, etc. perche' i neuroni sono cellule perenni, non sostituibili attraverso i processi di ricambio tissutale. Paradossalmente, l'amiloide non e' un vero stato denaturato, ma uno stato che puo' essere definito diversamente ordinato, non funzionale e con un folding caratteristico. La fibrilla amiloide ha la struttura riportata nella figura:
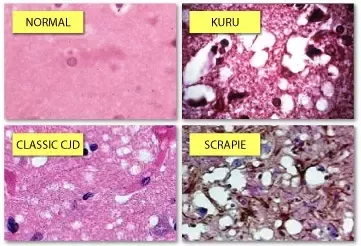
7) Poiche' tutte o molte proteine possono formare uno stato amiloide e poiche' l'aggregazione della fibrilla amiloide e' irreversibile, se si forma nella cellula un nucleo di amiloide questo tende ad accrescersi grazie alla deposizione di ulteriori proteine che temporaneamente assumono la configurazione opportuna e vengono stabilizzate in questa dall'aggregazione. Consegue che le malattie dovute alla deposizione di amiloide hanno decorso progressivo e possono occasionalmente comportarsi come malattie infettive (caso delle encefalopatie spongiformi del Kuru e della mucca pazza).