1. L'interazione tra proteine e piccole molecole (e non solo) e' un aspetto fondamentale dei processi biologici: include ad esempio il riconoscimento degli ormoni da parte dei recettori, la catalisi enzimatica, il trasporto di sostanze da un punto all'altro della cellula o dell'organismo, le reazioni tra antigeni e anticorpi, le reazioni tra farmaci e loro bersagli, etc.
2. Le reazioni chimiche di combinazione delle proteine con i loro ligandi sono governate dalla legge di azione delle masse, gia' vista a proposito dell'equilibrio chimico. In pratica:
Kd = [P] [X] / [PX]
[PX ] / [P]tot = [X] / (Kd + [X])
L'ultima equazione ci consente di definire la concentrazione di ligando necessaria per ottenere una qualsiasi frazione di saturazione della proteina (espressa come un multiplo o sottomultiplo della Kd). Ad esempio la X50, concentrazione di ligando libero necessaria per ottenere la semisaturazione ([PX]/[P]tot = 0,5) risulta:
3. L'interazione tra la proteina ed il ligando avviene in corrispondenza di una parte ben definita della struttura proteica, di solito una cavità aperta verso la superficie, chiama ta il sito di legame.
4. Nella cellula (o nei nostri esperimenti) possono essere presenti piu' ligandi per la stessa proteina che si combinano con lo stesso sito di legame o con siti diversi. Il rapporto tra proteine e ligandi in questi casi e' descritto come un linkage tra ligandi diversi.
5. Identical linkage: e' il caso nel quale il sistema contiene due ligandi che si legano in modo reciprocamente esclusivo allo stesso sito della proteina:
I due ligandi reagiscono indipendentemente, ciascuno soltanto con la specie P, secondo le reazioni:
P + X <==> PX ; KX = [P] [X] / [PX]
P + Y <==> PY ; KY = [P] [Y] / [PY]
Il polinomio di binding di questa proteina risulta:
[P]: specie di riferimento
[PX] = [P] [X]/KX
[PY] = [P] [Y]/KY
[P]tot = [P] (1 + [X]/KX + [Y]/KY)
A meno che le concentrazioni di entrambi i ligandi non siano molto basse, la concentrazione della specie non legata [P] potrebbe risultare trascurabile; l'equazione qui sopra potrebbe quindi essere semplificata in:
KP = KY / KX = [PX][Y] / [PY][X]
E' possibile esprimere la concentrazione di una specie in funzione di quella dell'altra; ad esempio: [PX] = [PY][X]KP / [Y]
[P]tot = [PY] + [PX] = [PY] (1 + [X]KP / [Y])
Se l'esperimento viene condotto variando la concentrazione del ligando X e mantenendo costante quella di Y, il termine [Y] KP puo' essere espresso come costante ([Y] KP = KP') e la funzione di binding si riduce ad una iperbole.

6. Heterotropic linkage; e' il caso nel quale il sistema contiene due ligandi che si legano a siti diversi della stessa proteina, in modo non mutuamente esclusivo. In questo caso e' possibile la formazione del complesso ternario PYX.
Lo schema di reazione e' riportato nella figura qui sopra e richiede quattro possibili reazioni, ciascuna con la sua costante di equilibrio; pero' soltanto tre costanti, comunque scelte, sono tra loro indipendenti, mentre la quarta deve essere uguale ad una combinazione delle altre tre. Definiamo:
P + X <==> PX ; KX = [P] [X] / [PX]
P + Y <==> PY ; KY = [P] [Y] / [PY]
PY + X <==> PYX ; YKX = [PY] [X] / [PYX]
PX + Y <==> PYX ; XKY = [PX] [Y] / [PYX]
Osserviamo che: XKY = KY YKX / KX
Il polinomio di binding di questa proteina risulta:
[P]: specie di riferimento
[PX] = [P] [X]/KX
[PY] = [P] [Y]/KY
[PYX] =[PY] [X]/YKX = [P] [Y] [X] /KY YKX
[P]tot = [P] (1 + [X]/KX + [Y]/KY + [Y] [X] /KY YKX)
Un trattamento piu' approfondito dei fenomeni di linkage si puo' trovare questo link.
7. Miscele di isoforme. In alcuni casi la cellula produce piu' di una sola proteina dello stesso tipo: ad esempio l'enzima lattico deidrogenasi e' presente in due varianti, codificate da geni distinti (per un ancestrale evento di duplicazione genica e divergenza mutazionale), e chiamate H (prevalente nel cuore, heart) e M (prevalente nel muscolo scheletrico). In questi casi ognuna delle due isoforme si combina con lo stesso ligando e la curva di saturazione e' data dalla somma pesata delle curve di saturazione di ciascuna isoforma.
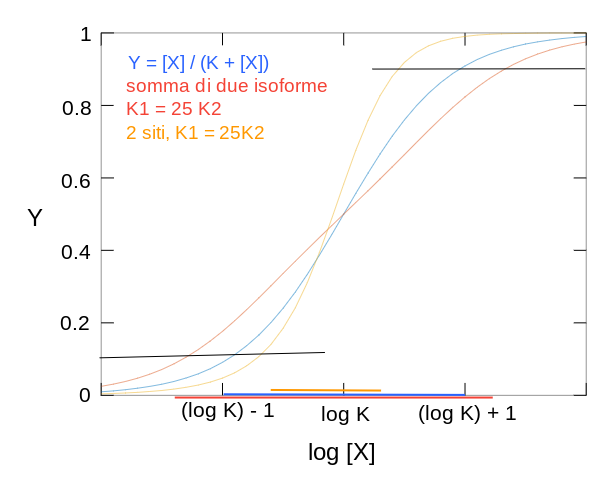
8. Grafici logaritmici e misure di pendenza: al punto 2 e' stato dimostrato che la frazione di proteina combinata con il ligando e' una funzione iperbolica della concentrazione del ligando. Se la stessa relazione viene posta in grafico riportando la concentrazione del ligando su una scala logaritmica, l'iperbole si trasforma in una sigmoide simmetrica il cui punto centrale ha coordinate (log X50 , 0,5). Il tratto centrale della sigmoide puo' essere approssimato ad una retta della quale e' possibile ed utile stimare la pendenza. Utilizzando le formule riportate nel precedente punto 2, si possono infatti stimare le concentrazioni di ligando necessarie per ottenere due valori di saturazione simmetrici rispetto al punto mediano della sigmoide; ad esempio:
[PX]/[P]tot = 0,75 richiede [X] = 3 Kd
Un'altra misura di pendenza del grafico di legame fu proposta dal fisiologo inglese (e premio Nobel) A.V. Hill nel 1911. Il grafico di Hill ha questa forma:
9. Proteine con piu' di un sito di legame per lo stesso ligando in genere sono composte da piu' subinita' simili o identiche, ma esistono eccezioni (ad es. la calmodulina ha una unica catena polipeptidica con 4 siti di legame per il calcio). In alcuni casi i siti di legame sono tra loro indipendenti ed hanno la stessa affinita' per il ligando; in altri casi sono eterogenei oppure presentano l'homotropic linkage (vedi sotto).
Se i siti di legame sono strong>identici e indipendenti ciascuno di essi reagisce col ligando come se si trovasse su una proteina monomerica e il polinomio di legame e' identico a quello di una proteina monomerica:
La distribuzione delle subunita' legate e non legate con il ligando negli oligomeri e' determinata soltanto dal caso, ed e' quindi descritta da leggi statististiche. In particolare, poiche' gli stati possibili per ogni sito sono soltanto due (legato e non legato) la distribuzione e' binomiale. Per una proteina con n subunita':
[P4]: specie di riferimento
[P4X] = 4 [P4] [X] / K
[P4X2] = 6 [P4] [X]2 / K2
[P4X3] = 4 [P4] [X]3 / K4
[P4X4] = [P4] [X]4 / K4
che non e' altro che il frazionamento di [P4, tot] = [P4] (1 + [X] / K)4
9. Homotropic linkage si verifica se la stessa proteina puo' legare piu' di una molecola dello stesso ligando, pero' con diversa costante di affinita':
9. Su quale intervallo di concentrazioni la proteina "risponde"? Il legame della proteina con il ligando puo' trasmettere un segnale; questo avviene ad esempio nel caso dei recettori degli ormoni. La cellula risponde al segnale quando una certa frazione dei suoi recettori e' occupata dall'ormone e gradua la sua risposta in funzione della frazione di recettori occupati. Per chiarire questo concetto e' utile riferirsi ad un grafico che riporti la frazione di recettore legato col ligando in funzione del logaritmo della concentrazione del ligando. In questo grafico l'iperbole diventa una sigmoide simmetrica: